Fe3О4 представляет собой оксид железа со смешанной валентностью, обладающий некоторыми основными свойствами, поэтому он может реагировать с HCl. Давайте посмотрим, что происходит, когда оба реагируют.
Fe3O4 железо присутствует в степенях окисления +2 и +3 из-за степени окисления +2, которая является основным свойством, и по этой причине оно может реагировать с HCl. Реакция не требует какого-либо катализатора или других параметров, таких как температура и давление.
Обсудим механизм реакции между HCl и Fe.3O4, энтальпия реакции, тип реакции, образование продукта и т. д. в следующей части статьи.
1. Что является продуктом HCl и Fe3O4?
Хлорид железа и хлорид железа образуются в качестве основного продукта вместе с молекулой воды при смешивании HCl и Fe3O4 подвержены реакции из-за различных степеней окисления железа.
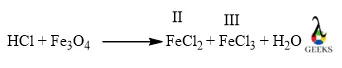
2. Какой тип реакции HCl + Fe3O4?
Реакция между HCl и оксидом железа смешанной валентности представляет собой окислительно-восстановительную реакцию, при которой атомы хлора окисляются, а железо восстанавливается. Кроме того, это один из видов кислотно-щелочной реакции наряду с реакцией осаждения, поскольку продукт осаждается.
3. Как сбалансировать HCl + Fe3O4?
HCl + Fe3O4 = FeCl2 + FeCl3 + H2О, эта реакция еще не уравновешена, потому что атомы не равны для левой и правой сторон, поэтому мы должны сбалансировать уравнение следующим образом:
- Шаг 1. Сначала мы обозначили все реагенты и продукты буквами A, B, C, D и E как коэффициенты, потому что присутствует пять молекул.
- Реакция будет выглядеть так,
- A HCl + B Fe3O4 = С FeCl2 + D FeCl3 + ЭХ2O
- Шаг 2 – Теперь используем уравнение подходящим номером, коэффициент уже обозначен буквой реагентов и продуктов.
- Fe = 3B = C + D, Cl = A = 2C + 2D, O = 4B = E, H = A = 2E
- Шаг 3. Теперь, используя исключение Гаусса, мы вычисляем значение каждого коэффициента и переменной,
- А = 8, В = 1, С = 1, D = 2 и Е = 4
- Итак, общее сбалансированное уравнение для вышеуказанной реакции:
- Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
4. HCl + Fe3O4 титрование
Fe3O4 можно титровать HCl с использованием подходящего индикатора для оценки количества железа в данном образце Fe.3O4, это можно сделать в некоторых процессах,
Используемый аппарат
Бюретка, коническая колба, держатель бюретки, мерная колба и химический стакан. необходимы для титрования.
Титр и титрант
Здесь в качестве титранта служила HCl, которую брали в бюретку, а Fe3O4 будет анализируемой молекулой.
Индикаторные
Титрование HCl и Fe3O4 делается в кислом рН. Фенолфталеин является идеальным индикатором, который имеет розовый цвет в щелочной среде и бесцветный в кислой среде.
Процедура
Бюретка заполнена стандартизированными HCl и Fe.3O4 отбирают в коническую колбу и смешивают с индикатором. Затем начинают титрование, добавляя по каплям HCl из бюретки в коническую колбу. Через некоторое время при достижении конечной точки индикатор показывает изменение цвета, что указывает на завершение титрования.
Повторяем титрование несколько раз для лучшего результата, а затем оцениваем количество железа по формуле V1S1 V =2S2.
5. HCl+Fe3O4 чистое ионное уравнение
Чистое ионное уравнение для HCl представляет собой протон вместе с хлоридом, а для продукта железо и хлорид железа вместе с ионами хлорида, протона и гидроксида поступают из воды.
H+ + Кл– + Фе3O4 = Fe2+ + 2Cl– + Фе3+ + 3Cl– + H+ + OH–
6. HCl+ Fe3O4 сопряженные пары
Сопряженные пары реакции HCl с Fe3O4 представляет собой сопряженное основание кислоты, которая представляет собой ион хлорида, а оксид представляет собой протонную форму молекулы вместе с катионом железа.
- Сопряженная пара HCl = Cl–
- Сопряженная пара Fe3O4 = HFe3O4+
7. HCl и Fe3O4 межмолекулярные силы
Межмолекулярная сила, присутствующая в HCl, представляет собой сильную электростатическую силу между протоном и ионом хлорида из-за полярности. В случае Fe3O4, наряду с ковалентной силой присутствует только ионное взаимодействие, поскольку молекула неполярна.
| молекула | Действующая сила |
| HCl | электростатический, ван дер вааль |
| Fe3O4 | ковалентная |
| FeCl2 | ионный |
| FeCl3 | Сильно ионный |
| H2O | электростатический, Н-связь, ковалентная |
Реагенты и продукты
8. HCl + Fe3O4 энтальпия реакции
Общая энтальпия реакции для реакции HCl и Fe3O4 рассчитывается по формуле энтальпия продукта – энтальпия реагентов.
| молекула | энтальпия (кДж/моль) |
| Fe3O4 | -1118.4 |
| HCl | -92.3 |
| FeCl2 | -341.8 |
| FeCl3 | -399.5 |
| H2O | -68 |
Реагенты и продукты
Таким образом, полное изменение энтальпии реакции является, +444 кДж/моль =[(-341.8)+2*(-399.5)+4*(-68)] – [(-1118.4)+8*(-92.3)] , что является положительным значением.
9. Соляная кислота + Fe3O4 буферный раствор?
Реакция между HCl и Fe3O4 не дает никакого буферного раствора, потому что Fe3O4 не основная соль.
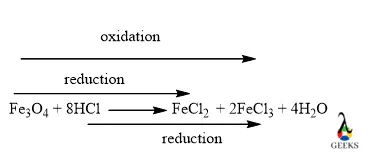
HCl и Fe3O4
10. Это HCl + Fe3O4 полная реакция?
Реакция между HCl и Fe3O4 близится к завершению, потому что он образует хлорид железа, хлорид железа и H2О после завершения реакции.
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
за 11 г. HCl + Fe3O4 экзотермическая или эндотермическая реакция?
Реакция между Fe3O4 и HCl эндотермический в соответствии с термодинамикой, потому что мы получаем положительное изменение энтальпии для реакции, которая означает, что реакция поглощает тепло или энергия продуктов намного ниже, чем энергия реагентов. Где δH всегда положителен.
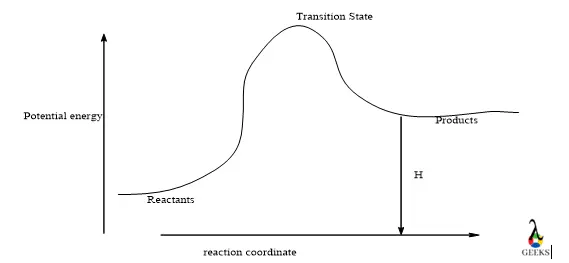
Эндотермическая реакция
12. Это HCl + Fe3O4 окислительно-восстановительная реакция?
Реакция HCl и Fe3O4 – это окислительно-восстановительная реакция где атомы хлора восстанавливаются, а железо окисляется за счет оксида смешанной валентности, а здесь окисляется атом кислорода.
13. Это HCl + Fe3O4 реакция осаждения
В реакции между HCl и Fe3O4, одним из образующихся продуктов является хлорид железа, который осаждается в растворе и находится в нижней части конической колбы.
14. Это HCl + Fe3O4 обратимая или необратимая реакция?
Реакция между HCl и Fe3O4 также необратима, так как может протекать только вперед.
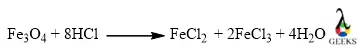
15. Является ли HCl + Fe3O4 реакция смещения?
Вышеупомянутая реакция между HCl и Fe3O4 представляет собой реакцию двойного замещения, в которой хлор из кислой части вытесняется на молекулы двухвалентного и хлоридного железа, а железо также вытесняется из его оксида с образованием соли и воды.
Заключение
Делаем вывод, что реакция HCl с Fe3O4 дает нам две молекулы хлорида со смешанной валентностью, где железо проявляет степени окисления +2 и +3. Потому что Fe3O4 представляет собой комплекс шпинели в металлоорганической химии.
Узнайте больше о Факты о HCl + CaOCl2, Факты о HCl + Ag и Facts on HCl + AgCl.

Hi……I am Biswarup Chandra Dey, I have completed my Master’s in Chemistry from the Central University of Punjab. My area of specialization is Inorganic Chemistry. Chemistry is not all about reading line by line and memorizing, it is a concept to understand in an easy way and here I am sharing with you the concept about chemistry which I learn because knowledge is worth to share it.